五氧化二磷

 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP | 十氧化四磷 | |
|---|---|
 | |
 | |
| 别名 | 氧化磷(V) 磷酸酐 |
| 识别 | |
CAS号 | 1314-56-3 16752-60-6((P4O10)) |
PubChem | 14812 |
ChemSpider | 14128 |
SMILES |
|
ChEBI | 37376 |
RTECS | TH3945000 |
| 性质 | |
化学式 | P4O10 |
摩尔质量 | 283.889 g·mol⁻¹ |
| 外观 | 白色粉末 吸水性 刺激性气味 |
密度 | 2.39 g/cm3 |
熔点 | 569 °C |
沸点 | 360 °C (昇華) |
溶解性(水) | 水解 |
蒸氣壓 | 1 mmHg, 384 °C |
| 危险性 | |
欧盟分类 | 未列明 |
| 主要危害 | 強烈脫水性 (或吸水性) |
NFPA 704 |  1 3 3 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
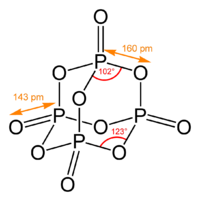
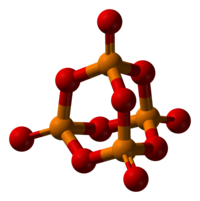
五氧化二磷(化学式:P2O5,分子式:P4O10),磷在空气中燃烧生成的磷氧化物。它吸水性强、并有极强的脱水性,甚至可以将浓硫酸脱水,生成三氧化硫。极易潮解,是一种强力干燥剂。它与冷水生成偏磷酸,与热水主要生成正磷酸。
目录
1 用途
2 制备
3 安全
4 參見
5 参考资料
用途
用于制高纯高磷酸、有机合成以及气体的干燥剂,或用于制备多聚磷酸。
五氧化二磷是效果很好的脱水剂,因为它的水合过程是放热的:
- P4O10+6H2O=4H3PO4ΔH⊖=−177kJ/moldisplaystyle mathrm P_4O_10+6H_2O=4H_3PO_4 quad Delta H^ominus mathrm =-177kJ/mol
不过其脱水产物为一层粘稠的液体,容易覆盖在未反应的五氧化二磷表面,导致其脱水能力下降。通常在干燥器中使用的是五氧化二磷的颗粒。
五氧化二磷的干燥性能很强,因而有机合成中常用它作脱水剂。其中最重要的用途是将酰胺转变为腈类:[1]
- P4O10+RC(O)NH2→P4O9(OH)2+RCNdisplaystyle P_4O_10+RC(O)NH_2rightarrow P_4O_9(OH)_2+RCN
其中P4O9(OH)2只是用来理想化地表示P4O10的脱水产物。
另外它也能与羧酸反应,得到酸酐:[2]
- P4O10+RCO2H→P4O9(OH)2+[RC(O)]2Odisplaystyle P_4O_10+RCO_2Hrightarrow P_4O_9(OH)_2+left[RC(O)right]_2O
五氧化二磷溶于DMSO中得到的溶液称为Onodera试剂,能够发生斯文氧化反应,将醇氧化为醛[3]。
五氧化二磷还可以将许多无机酸转变为对应的酸酐。例如:HNO3转变为N2O5、H2SO4转变为SO3、HClO4转变为Cl2O7、HCF3SO3转变为(CF3)2S2O5。
制备
P2O5由磷在充足氧气下燃烧生成。
- P4+5O2=2P2O5displaystyle P_4+5O_2=2P_2O_5
安全
它與水的反應劇烈,對水含物質,如木材或棉花,會釋放大量的熱,甚至引起火災。對金屬有腐蝕性。即使在低至濃度為1毫克/米3,對人還是可能導致嚴重燒傷眼睛,皮膚,粘膜和呼吸道。
參見
- 氧
- 磷
参考资料
^ Meier, M. S. "Phosphorus(V) Oxide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
^ Joseph C. Salamone (编). Polymeric materials encyclopedia: C, Volume 2. CRC Press. 1996: 1417. ISBN 0-8493-2470-X.
^ Tidwell,
T. T. "Dimethyl Sulfoxide–Phosphorus Pentoxide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


![displaystyle P_4O_10+RCO_2Hrightarrow P_4O_9(OH)_2+left[RC(O)right]_2O](https://wikimedia.org/api/rest_v1/media/math/render/svg/f59ecfb1c9608c33e521eb1660fd99c804eaee09)
