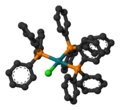
威尔金森催化剂

 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP
| 威尔金森催化剂 | |
|---|---|
 | |
 | |
 | |
 | |
IUPAC名 (SP-4)chloridotris(triphenylphosphane) rhodium | |
| 别名 | Rhodium(I) tris- (triphenylphosphine) chloride, Wilkinson’s catalyst, Tris(triphenylphosphine)- rhodium chloride |
| 识别 | |
CAS号 | 14694-95-2 |
PubChem | 84599 |
EINECS | 238-744-5 |
RTECS | 无 |
| 性质 | |
化学式 | C54H45ClP3Rh |
摩尔质量 | 925.22 g·mol⁻¹ |
| 外观 | 红色固体 |
熔点 | 245-250℃ |
溶解性(水) | 不溶于水 |
溶解性(其他溶剂) | 苯 |
| 结构 | |
配位几何 | 平面正方形 |
| 危险性 | |
警示术语 | R:无 |
安全术语 | S:S22 S24/25 |
| 主要危害 | 无 |
| 相关物质 | |
| 相关化学品 | 三苯基膦 四(三苯基膦)钯 羰基二(三苯基膦)氯化铱 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
威尔金森催化剂(英语:Wilkinson's catalyst),即氯化三(三苯基膦)合铑(I),是由已故的英国化学家杰弗里·威尔金森爵士在1966年发现的一种金属铑的络合物。[1]
目录
1 催化剂结构和基本性质
2 催化剂的应用
3 威尔金森催化剂的其他反应
4 参考资料
催化剂结构和基本性质
威尔金森催化剂分子具有平面正方形和16个价电子。通常是由过量的三苯基膦和水合三氯化铑在乙醇中加热回流反应制得的紫红色晶状固体[2][3]。过量的三苯基膦作为还原剂用于将三价的铑还原成一价铑同时生成三苯基氧化膦。
- RhCl3(H2O)3 + 4 PPh3 → RhCl(PPh3)3 + O=PPh3 + 2 HCl + 2 H2O
催化剂的应用
威尔金森催化剂可用于烯烃的催化氢化[4][5]。反应的机理是:首先发生一个或者两个三苯基膦配体的解离分别形成12或14个电子的络合物,接着发生氢分子对金属原子的氧化加成,随后与烯烃形成Π-络合物,之后是进行分子内的氢转移,最后发生还原消除生成一个产物烷烃。

威尔金森催化剂的其他应用包括用于催化烯烃与儿茶酚硼烷或频那醇硼烷的硼氢化反应[6]、催化三乙基硅氢对α,β-不饱和羰基化合物的选择性1,4-还原[7]。将威尔金森催化剂中的两个三苯基膦用手性的双齿膦配体(比如Chiraphos)置换,就能得到可以将潜手性的烯烃氢化还原成手性烷烃的不对称催化剂[8]。
威尔金森催化剂的其他反应
RhCl(PPh3)3与一氧化碳反应得到沃什卡络合物的类似物trans-RhCl(CO)(PPh3)2(它的反应活性远小于沃什卡络合物)。trans-RhCl(CO)(PPh3)2也可由威尔金森催化剂和醛发生脱羰反应得到
- RhCl(PPh3)3 + RCHO → RhCl(CO)(PPh3)2 + RH + PPh3
RhCl(PPh3)3在苯中搅拌后会发生二聚反应,析出在苯中溶解性较差的红色Rh2Cl2(PPh3)4。
参考资料
^ Osborn, J. A.; Jardine, F. H.; Young, J. F.; Wilkinson, G. The Preparation and Properties of Tris(triphenylphosphine)halogenorhodium(I) and Some Reactions Thereof Including Catalytic Homogeneous Hydrogenation of Olefins and Acetylenes and Their Derivatives. Journal of the Chemical Society A. 1966: 1711–1732. doi:10.1039/J19660001711.
^ Bennett, M. A.; Longstaff, P. A. Complexes of Rhodium(I) with Triphenylphosphine. Chem. Ind. (London) 1965, p.846.
^ Osborn, J. A.; Jardine, F. H., Young, J. F., Wilkinson, G. The preparation and properties of tris(triphenylphosphine)halogenorhodium(I) and some reactions thereof including catalytic homogeneous hydrogenation of olefins and acetylenes and their derivatives. Journal of the Chemical Society A. 1966-01-01: 1711. doi:10.1039/J19660001711. 引文使用过时参数coauthors (帮助)
^ A. J. Birch, D. H. Williamson (1976). Organic Reactions 24: 1ff
^ B.R. James, Homogeneous Hydrogenation. John Wiley & Sons, New York, 1973
^ D. A. Evans, G. C. Fu and A. H. Hoveyda. Rhodium(I)-catalyzed hydroboration of olefins. The documentation of regio- and stereochemical control in cyclic and acyclic systems. J. Am. Chem. Soc. 1988, 110: 6917–6918. doi:10.1021/ja00228a068.
^ I. Ojima, T. Kogure. Selective reduction of α,β-unsaturated terpene carbonyl compounds using hydrosilane-rhodium(I) complex combinations. Tetrahedron Lett. 1972, 13 (49): 5035–5038. doi:10.1016/S0040-4039(01)85162-5.
^ W. S. Knowles. Asymmetric Hydrogenations (Nobel Lecture 2001). Advanced Synthesis and Catalysis. 2003, 345 (12): 3–13. doi:10.1002/adsc.200390028.