铜

 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
红橙色帶金屬光澤  純銅 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 銅(copper)·Cu·29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 過渡金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 11·4·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 63.546(3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氬] 3d10 4s1 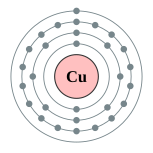 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 8.96 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熔點時液體密度 | 8.02 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 1357.77 K,1084.62 °C,1984.32 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 2835 K,2562 °C,4643 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 13.26 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 300.4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 24.440 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸汽壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | +1、+2、+3、+4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 1.90(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:745.5 kJ·mol−1 (更多) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 132±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 面心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)1.678×10-8 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 401 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)16.5 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
聲速(細棒) | (室溫)3810 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 110-128 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 48 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 140 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 3.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 343–369 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 235–878 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-50-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:銅的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
铜(英语:copper)是化学元素,化学符号Cu(来自拉丁语:cuprum)[2],原子序数29。纯铜是柔软的金属,表面刚切开时为红橙色帶金屬光澤、延展性好、导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,以及組成众多種合金。铜合金机械性能优异,电阻率很低,其中最重要的是青铜和黄铜。此外,铜也是耐用的金属,可以多次回收而无损其机械性能。
人类使用铜及其合金已有数千年历史。古罗马时期铜的主要开采地是塞浦路斯,因此最初得名cyprium(意为塞浦路斯的金属),后来变为cuprum,这是英语:copper、法语:cuivre和德語:Kupfer的来源。[3]二价铜盐是常见的铜化合物,常呈蓝色或绿色,是蓝铜矿和绿松石等矿物颜色的来源,历史上曾广泛用作颜料。铜质建筑结构受腐蚀后会产生铜绿(碱式碳酸铜)。装饰艺术主要使用金属铜和含铜的颜料。
铜是所有生物所必需的微量膳食矿物质,因为它是呼吸酶复合体细胞色素c氧化酶的关键组分。软体动物和甲壳亚门动物的血液色素血蓝蛋白中含有铜。鱼类和其他哺乳动物的血液中则是含铁的复合物血红蛋白。铜在人体中主要分布于肝脏、肌肉和骨骼中。[4]铜的化合物可用作抑菌剂、杀真菌剂和木材防腐剂。
目录
1 性质
1.1 物理性质
1.2 化学性质
1.3 同位素
1.4 存在
2 生产
2.1 储量
2.2 方法
2.3 回收
3 合金
4 化合物
4.1 简单化合物
4.2 配合物化学
4.3 有机铜化学
4.4 三价铜和四价铜
5 歷史
5.1 红铜时代
5.2 青铜时代
6 應用
7 銅對人體的影響
8 世界10大銅消費國之消費量
9 参考文献
性质
物理性质

99.95%纯度的铜连铸而成的圆盘,经蚀刻后呈现出微晶

铜的温度略高于熔点时,它的粉色光泽盖过了因炽热而呈现的橙色

銅線和含鹵素物質在灼燒下火焰呈亮綠色。
铜位于元素周期表第11族,同族的还有银和金,这些金属的共同特点有延展性高、导电性好。这些元素的原子最外层只有一个电子,位于s亚层,次外层电子d亚层全满。原子间的相互作用以s亚层电子形成的金属键为主,而全满的d亚层的影响不大。与d亚层未满的金属原子不同,铜的金属键共价成分不多,而且很弱,所以单晶铜硬度低、延展性高。[5] 宏观上,晶格中广泛存在的缺陷(如晶界),阻碍了材料在外加压力下的流动,从而使硬度增加。因此,常见的铜是细粒多晶,硬度比单晶铜更高。[6]
铜不但柔软,导电性(59.6×106 S/m)、导热性(401 W/(m·K))也好,室温下在金属单质中仅次于银。[7] 这是因为室温下电子在金属中运动的阻力主要来自于电子因晶格热振动而发生的散射,而较柔软的金属散射则较弱。[5] 铜在露天环境下所允许的最大电流密度为3.1×106 A/m2(横截面),更大的电流就会使之过热。[8] 像其他金属一样,铜和其他金属并置会发生电化腐蚀。[9]
铜是四种天然色泽不是灰色或银色的金属元素之一,另外三种是铯、金(黄色)和锇(蓝色)。[10] 纯净的铜单质呈橙红色的,接触空气以后失去光泽而变红。铜的这种特殊颜色是由于全满的3d亚层和半满的4s亚层之间的电子跃迁——这两个亚层之间的能量差正好对应于橙光。铯和金呈黄色也是这个原理。[5]
化学性质

未氧化的铜线(左)和已氧化的铜线(右)

爱丁堡皇家天文台东塔楼,2010年翻新时安装的铜和1894年原有的铜(绿色)形成鲜明对比
铜不和水反应,但和空气中的氧气缓慢反应,形成一层棕褐色的氧化铜,但和铁暴露在潮湿空气中形成铁锈不同,铜锈能保护下面的铜免受进一步腐蚀。铜质建筑物(如自由女神像)上常可见到一层铜绿(碱式碳酸铜)[11]铜接触硫后因生成各种硫化物而失去光泽。[12]铜的氧化态有0、+1、+2、+3、+4,其中+1和+2是常见氧化态。+3氧化态的有六氟合铜(III)酸钾,+4氧化态的有六氟合铜(IV)酸铯,0氧化态的Cu(CO)2可通过气相反应再用基质隔离方法检测到[13]。
铜容易被卤素、互卤化物、硫、硒腐蚀,硫化橡胶可以使铜变黑。铜在室温下不和四氧化二氮反应,但在硝基甲烷、乙腈、乙醚或乙酸乙酯存在时,则生成硝酸铜:
- Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
金属铜易溶于硝酸等氧化性酸,若无氧化剂或适宜配位试剂的存在时,则不溶于非氧化性酸,如:
- 铜和硝酸的反应如下:
- 3 Cu + 8 HNO3(稀) → 3 Cu(NO3)2 + 2 NO↑ + 4 H2O
- Cu + 4 HNO3(浓) → Cu(NO3)2 + 2 NO2↑ + 2 H2O
- 和浓硫酸的反应为:
- Cu + 2 H2SO4(浓) → CuSO4 + SO2↑ + 2 H2O
- 和浓硫酸的反应产物还和温度有一定关系。反应过程中硫酸逐渐变稀,直到反应停止。铜不能和稀硫酸反应,但是有氧气存在时,按下式反应:
- 2 Cu + O2 + 2 H2SO4 —Δ→ 2 CuSO4 + 2 H2O
- 铜可溶于氯酸或经过酸化的氯酸盐:
- 3 Cu + 6 H+ + ClO3− → 3 Cu2+ + Cl− + 3 H2O
- 存在硫脲时发生配位反应:
- 2 Cu + 6 S=C(NH2)2 +2 HCl → 2Cu(I)(S=C(NH2)2)3Cl + H2[14]
- 和浓盐酸反应形成配合物:[15]
- 2 Cu + 8 HCl(浓) → 2 H3[CuCl4] + H2↑
铜在酸性条件下能和高锝酸根离子反应,使高锝酸根离子还原为单质锝:
- 7 Cu + 2 TcO4- + 16 H+ → 2 Tc + 7 Cu2+ + 8 H2O[16]
铜和硫化亚铁加热可以发生置换反应:
- 2 Cu + FeS → Cu2S + Fe
铜加热可以和三氧化硫反应,主要反应有两种:
- 4 Cu + SO3 → CuS + 3 CuO
- Cu + SO3 → CuO + SO2
銅在乾燥空氣中稳定,可保持金屬光澤。但在潮溼空氣中,表面會生成一層銅绿(碱式碳酸铜,分子式:Cu2(OH)2CO3),保護內層的銅不再被氧化。反应方程式:
- 2 Cu + O2 + CO2 + H2O → Cu2(OH)2CO3
同位素
铜有29个同位素。63Cu和65Cu很稳定,63Cu在自然存在的铜中约占69%;它们的自旋量子数都为3/2。[17]其他同位素都有放射性,其中最稳定的是67Cu,半衰期61.83小时。[17]已确定7个亚稳态核素的特性,其中68mCu半衰期最长,为3.8分钟。质量数64以上的核素發生β衰变,质量数64以下的核素發生正电子发射。64Cu两种衰变都会發生,半衰期12.7小时。[18]
62Cu和64Cu有重要应用。62Cu在62Cu-PTSM中用作正电子发射断层扫描的放射性示踪剂。[19]
存在
File:Native Copper from the Keweenaw Peninsula Michigan.jpg
铜在巨型恒星中生成[20],在地壳中丰度约为50 ppm[21],存在形式为自然铜,硫化物矿(黄铜矿和辉铜矿),碳酸铜矿(蓝铜矿和孔雀石),还有氧化亚铜矿(赤铜矿)。[7]已知的最大一块单质铜重420吨,在1857年于美国密歇根州凯韦诺半岛发现。[21]自然铜是一种多晶,记录到的最大的单晶尺寸为4.4×3.2×3.2厘米。[22]
生产
铜在地壳中的含量约为0.01%。大部分铜都是从斑岩铜矿中露天开采提取的。这种铜矿含有0.4%到1.0%的铜。智利的丘基卡马塔,美国犹他州的宾厄姆峡谷矿和美国新墨西哥州的奇诺矿就是这种铜矿。根据英国地质调查局(BGS)统计,2005年智利铜矿产量最高,占到全球产量三分之一强,接下来是美国、印度尼西亚和秘鲁。[7] 铜也可由原地浸出法开采,亚利桑那州的几个铜矿是这种方法的首选。[23] 铜的使用量还在增加,而可开采量仅能满足所有国家达到发达国家的使用量。[24]

位於智利丘基卡马塔的露天銅礦場
储量
铜的使用已有一万年的历史,但有95%的铜是在1900年后开采冶炼的[25],超过半数的铜是在近24年开采的。像很多自然资源一样,铜在地球中的总储量十分巨大(在距离地表一公里以内的地壳中约有1014吨,以现在的速度可开采五百万年。不过,以现在的技术水平和物价,这些储量中只有一小部分在经济上有开采价值。对现有可开采储量的估计从25年到60年不等,这取决于对增长率等核心指标的假设。[26] 现在也有很大一部分铜来源于回收。[25] 未来铜的供求状况是个颇有争议的话题,其中涉及类似于哈伯特顶点的产量顶点。
铜价历来波动很大[27],在1999年6月创下0.60美元每磅(1.32美元每公斤)后便翻了六倍,升至2006年5月的3.75美元每磅(8.27美元每公斤),到了2007年2月又降至2.40美元每磅(5.29美元每公斤),到同年4月又反弹至3.50美元每磅(7.71美元每公斤)[28] 2009年2月,全球需求疲软和商品价格下跌使得铜价从一年前的高点回落至1.51美元每磅。[29]
方法

闪速熔炼过程示意图
铜矿的平均含铜量仅为0.6%,商业铜矿主要是硫化物矿,特别是黄铜矿(CuFeS2),其次是辉铜矿(Cu2S)。[30] 矿石粉碎后经过泡沫浮选或生物浸出浓缩,含铜量提高至10%到15%。[31] 然后把矿石与二氧化硅一起闪速熔炼,可把铁转化为矿渣除去。这个过程利用了铁的硫化物更容易转化成氧化物,然后和二氧化硅反应生成硅酸盐矿渣漂浮在热熔物表面的特点。生成的铜锍成分为硫化亚铜,焙烧后转化成氧化亚铜:[30]
- 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
继续加热后氧化亚铜转化为粗铜:
- 2 Cu2O → 4 Cu + O2
这种工艺只把一半的硫化物转化成氧化物,生成的氧化物再把其余的硫化物氧化后去除。所得产物经过电解精炼,阳极泥里所含的金和铂还可利用。这一步利用了铜的氧化物容易还原成金属单质的特点。先用天然气在粗铜上吹以去除大部分剩余的氧化物,然后再对产物进行电解精炼,得到纯铜。[32]
- Cu2+ + 2 e− → Cu
回收
铜像铝一样,不管是原材料还是在产品中,都能100%回收。按体积计算,铜的回收量仅次于铁和铝,排名第三。估计已开采出的铜有80%现在仍在使用。[33] 根据国际资源小组在《社会的金属存量》报告估计,全球社会人均拥有35到55公斤铜可以使用,其中发达国家人均拥有量较高(140到300公斤),而欠发达国家人均拥有量较低(30到40公斤)。[34]
铜的回收过程和开采过程基本相同,但步骤更少。高纯度的废铜在熔炉中熔化、还原、然后铸造成坯和锭。低纯度的废铜通过在硫酸中电镀的方法精炼。[35]
合金
铜合金种类众多,用途重要。黄铜是铜锌合金。青铜通常指铜锡合金,但也可指铝青铜等其他铜合金。在珠宝业中,铜是克拉金、克拉银等合金的重要组分之一[36],也用于克拉金的焊料,能改变合金的颜色、硬度和熔点。[37]
铜和镍的合金称为白铜,用于小面额硬币,常用作包层。5美分硬币(nickel)含75%铜,25%镍,为匀质材料。90%铜和10%镍的合金抗腐蚀性能优异,用于各种接触海水的零件部位。铜铝合金(约含7%铝)呈金色,用于装饰,令人赏心悦目。[21] 有些不含铅的焊料就是锡和一小部分铜等其他金属的合金。[38]
化合物
铜化合物种类繁多,其最常见的氧化数是+1和+2,分别称为亚铜(cuprous)和铜(cupric)。[39]
简单化合物
和其他元素一样,铜能够形成二元化合物,即只有两种元素组成的化合物,主要有氧化物、硫化物和卤化物。氧化物有氧化亚铜和氧化铜,硫化物有很多种,其中硫化亚铜和硫化铜较为重要。
铜的一价卤化物有氯化亚铜、溴化亚铜和碘化亚铜,二价卤化物有氟化铜、氯化铜和溴化铜。若尝试制备碘化铜,则会得到碘化亚铜和碘单质。[40]
- 2 Cu2+ + 4 I− → 2 CuI + I2
铜的其它简单化合物有硫酸铜、硝酸铜、乙酸铜、四氟硼酸铜等,这些化合物都有蓝色调(乙酸铜蓝绿)。不溶的有氢氧化铜、氢氧化亚铜、碱式碳酸铜等。
配合物化学

二价铜在氨配体存在时呈亮蓝色。这是硫酸四氨合铜
和其他金属一样,铜和其他配体形成配合物。在水溶液中的二价铜以[Cu(H2O)6]2+离子存在,在过渡金属水合络合物中具有最大的水分子交换速率(即水分子配体结合和分离的速率)。加入氢氧化钠后形成亮蓝色的氢氧化铜沉淀。反应方程式可简单写成:
- Cu2+ + 2 OH− → Cu(OH)2
加入氨水会发生类似反应。氨水过量时沉淀溶解,生成氢氧化四氨合铜:
- Cu(H2O)4(OH)2 + 4 NH3 → [Cu(H2O)2(NH3)4]2+ + 2 H2O + 2 OH−
铜也可以和其他含氧酸根离子形成配合物,如乙酸铜、硝酸铜和碳酸铜。硫酸铜可生成五水合物的蓝色晶体,是实验室中最常见的铜化合物,还用于杀真菌剂波尔多液。

配合物[Cu(NH3)4(H2O)2]2+的球棒模型,显示了二价铜常见的八面体形分子构型
多元醇(即含有多于一个羟基的有机化合物)一般都能与铜盐反应。例如,铜盐能用于检验还原糖。特别是本内迪克特试剂和斐林试剂在有糖存在的情况下会变色,从蓝色的二价铜变为红色的氧化亚铜。[41]施魏策尔试剂和其他相关的乙二胺等胺配合物能溶解纤维素。[42]氨基酸能与二价铜形成螯合物。有很多液相检验二价铜离子的方法,如亚铁氰化钾与二价铜盐生成棕色沉淀。
有机铜化学
有机铜化合物是含有碳铜键的化合物。它们容易和氧气反应,生成氧化亚铜,在化学中有很多用途。这种化合物可由一价铜和格氏试剂、末端炔烴或有机锂化合物反应生成[43],特别是最后一个反应会生成吉尔曼试剂。这些试剂能和卤代烷烃发生取代反应形成偶联化合物,因此在有机合成中很重要。乙炔铜对震动高度敏感,是卡迪奥-肖德凯维奇偶联反应[44] 和薗头耦合反应的中间产物。[45] 有机铜化合物还能对不饱和醛酮进行亲核共轭加成[46],以及对炔烃进行亲核加成。[47] 一价铜能与烯烃和一氧化碳形成多种结合较弱的配合物,特别是当有氨作为配体时。[48]
三价铜和四价铜
三价铜通常以氧化物方式存在,例如蓝黑色固体銅(III)酸鉀。[49]研究最深入的三价铜化合物是含銅(III)酸根的高溫超導體。钇钡铜氧就含有二价和三价的铜。像氧离子一样,氟离子也有很强的碱性[50],能稳定金属离子的较高价态。确实有三价铜和四价铜的氟化物,如六氟合铜(III)酸钾和六氟合铜(IV)酸铯。[39]
一些含铜的蛋白质含有三价铜,与氧配体相结合。[51]四肽中未结合质子的酰胺配体能稳定三价铜,形成紫色配合物。[52]
歷史
红铜时代
有记载的最古老的几个文明知道自然界中存在着自然铜,其应用有至少一万年的历史。据估计,铜最早在公元前9千年的中东发现[53],在伊拉克北部出土了8700年前的铜质坠饰。[54] 有证据显示在此之前人类使用的金属只有金和陨铁(但没有炼铁)。[55] 据信炼铜的历史发展顺序如下:(1)自然铜的冷加工、(2)退火、(3)冶炼、(4)失蜡法铸造。在东南安那托利亚,这四种冶金方式在公元前7500年的新石器时代初期几乎同时出现。[56] 不过,炼铜在世界各地独立出现,就像农业一样。公元前2800年以前的中国,公元后600年的中美洲,公元后九至十世纪的非洲都可能已经发现铜的冶炼方法。[57]熔模铸造发现于公元前4500到4000年的东南亚。[53]碳测年确定英国柴郡的阿尔德利埃奇在公元前2280年到1890年已经有铜的开采。[58] 生活在3300到3200年前的冰人奥茨出土时带有一把斧子,斧头是99.7%纯的铜,另外他的头发砷含量很高,这表明他从事过铜的冶炼。[59] 铜的使用经验有助于开发其他金属为己所用,特别是炼铜使人类发明了炼铁。[59] 位于现在密歇根州和威斯康星州的旧红铜文明群在公元前6000到3000年之间就在生产铜。[60][61]
青铜时代
在发明炼铜之后的4000年,人类开始把铜和锡熔炼成合金,是为青铜。温查文明在公元前4500年就出现了青铜器。[62]苏美尔和古埃及的青铜器出现在公元前3000年。[63] 东南欧的青铜时代在公元前3700到3300年开启,西北欧则在公元前2500年开启。后来,近东在公元前2000到1000年进入铁器时代,北欧则是公元前600年。
铜是古代就已经知道的金属之一。一般认为人类知道的第一种金属是金,其次就是铜。铜在自然界储量非常丰富,并且加工方便。铜是人类用于生产的第一种金属,最初人们使用的只是存在于自然界中的天然单质铜,用石斧把它砍下来,便可以锤打成多种器物。随着生产的发展,只是使用天然铜制造的生产工具就不敷应用了,生产的发展促使人们找到了从铜矿中取得铜的方法。
含铜的矿物比较多见,大多具有鲜艳而引人注目的颜色,例如:金黄色的黄铜矿CuFeS2,鲜绿色的孔雀石CuCO3Cu(OH)2,深蓝色的石青2CuCO3Cu(OH)2,赤銅礦Cu2O,輝銅礦Cu2S等,把这些矿石在空气中焙烧后形成氧化铜CuO,再用碳还原,就得到金属铜。反应方程式:
- 2CuO+C→Δ2Cu+CO2↑displaystyle rm 2CuO+Cxrightarrow Delta 2Cu+CO_2uparrow
,另外,斑銅礦也是很常見的銅礦石。
纯铜制成的器物太软,易弯曲。人们发现把锡掺到铜裡去,可以制成铜锡合金──青铜。青铜比纯铜坚硬,使人们制成的劳动工具和武器有了很大改进,人类进入了青铜时代,结束了人类历史上的新石器时代。
應用

銅電線

各式銅水管的管件
- 铜的价格在10~5美元每千克(相比较银850-550美元每千克)。
- 銅的最普遍用途在於製造電線,通常現時所用的電線都是由純銅製成,這是因為它的導電性和導熱性都僅次於銀,但卻比銀便宜得多。而且銅很容易加工,透過熔解、鑄造、壓延等工序改變形狀,便可製成汽車零件以及電子零件。這些經過加工的銅製品,統稱為「伸銅品」。
而銅可用於製造多種合金,銅的重要合金有以下幾種:
黃銅
黃銅是銅與鋅的合金,因色黃而得名。黃銅的機械性能和耐磨性能都很好,可用於製造精密儀器、船舶的零件、槍炮的彈殼、水龍頭等。黃銅敲起來聲音好聽,因此鑼、鈸、鈴、號等樂器都是用黃銅制做的。- 航海黃銅
銅與鋅、錫的合金,抗海水侵蝕,可用來製作船的零件、平衡器。
青銅
銅與錫的合金叫青銅,因色青而得名。在古代為常用合金(如中國的青銅時代)。青銅一般具有較好的耐腐蝕性、耐磨性、鑄造性和優良的機械性能,且硬度大。用於製造精密軸承、高壓軸承、船舶上抗海水腐蝕的機械零件以及各種板材、管材、棒材等。青銅還有一個反常的特性——“熱縮冷脹”,用來鑄造塑像,冷卻後膨脹,可以使眉目更清楚。
磷青銅
磷青銅是銅、錫與磷的合金,其中含有錫2%-8%,含有磷2-8%,其餘成分余為銅。堅硬,可製彈簧。鑄件可用於齒輪、蝸輪、軸承等機械部件。
白銅
白銅是銅與鎳的合金,其色澤和銀一樣,銀光閃閃,不易生銹。常用於製造硬幣、電器、儀錶和裝飾品。
十八開金(18K金或稱玫瑰金)
6/24的銅與18/24的金的合金。紅黃色,硬度大,可用來製作首飾、裝飾品。
銅對人體的影響

高銅質的食物
銅的離子(銅質)對生物而言,不論是動物或植物,是必需的元素。人體缺乏銅會引起貧血,毛髮異常,骨骼和動脈異常,以至腦障礙。但如過剩,會引起肝硬化、腹瀉、嘔吐、運動障礙和知覺神經障礙。
一般來說,牛肉、葵花籽、可可、黑椒、羊肝等等都有豐富的銅質。
正常人體內含銅100-200毫克,約50%-70%存在肌肉及骨骼,20%存在肝臟,5%-10%分佈於血液。
從食物吸收的銅進入肝門靜脈(Hepatic portal vein),在血漿中銅與白蛋白(Albumin,ALB)形成鬆散的結合,運送至肝臟內儲存與供體內利用。肝中合成原血漿銅藍蛋白(apoceruloplasmin),與銅牢固結合形成血漿銅藍蛋白(ceruloplasmin),約佔成人血漿銅的95%,釋入血漿運送全身。
世界10大銅消費國之消費量
單位:千公噸
| 國名 | 1977 | 1982 | 1987 | 1992 |
|---|---|---|---|---|
| 美國 | 1986.6 | 1664.2 | 1276.7 | 2057.8 |
| 日本 | 1127.1 | 1243.0 | 1276.6 | 1613.2 |
| 德國 | 894.9 | 847.8 | 970.1 | 994.8 |
| 前蘇聯 | 1290.0 | 1320.0 | 1270.0 | 880.0 |
| 中國 | 346.0 | 398.0 | 470.0 | 590.0 |
| 法國 | 326.1 | 419.0 | 399.0 | 481.2 |
| 義大利 | 326.0 | 342.0 | 420.0 | 470.7 |
| 比利時 | 295.4 | 277.1 | 291.8 | 372.0 |
| 南韓 | 53.2 | 131.9 | 259.0 | 343.2 |
| 英國 | 512.2 | 355.4 | 327.7 | 269.4 |
| 十大國消費量 | 7157.5 | 6998.4 | 7810.9 | 8072.3 |
| 全球消費量 | 9059.9 | 9033.1 | 10413.6 | 10714.0 |
参考文献
^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存檔,存档日期2011-03-03. in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
^ Enghag. Encyclopedia of the Elements. Wiley-VCH. 2004: 144. ISBN 3-527-30666-8.
^ Encyclopaedia Britannica 11th ed., vol. 7. : 102.
^ Johnson, MD PhD, Larry E. (编). Copper. Merck Manual Home Health Handbook. Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc. 2008 [2013-04-07].
^ 5.05.15.2 George L. Trigg; Edmund H. Immergut. Encyclopedia of applied physics. 4: Combustion to Diamagnetism. VCH Publishers. 1992-11-01: 267–272 [2011-05-02]. ISBN 978-3-527-28126-8.
^ Smith, William F. & Hashemi, Javad. Foundations of Materials Science and Engineering. McGraw-Hill Professional. 2003: 223. ISBN 0-07-292194-3.
^ 7.07.17.2 Hammond, C. R. The Elements, in Handbook of Chemistry and Physics 81st. CRC press. 2004. ISBN 0-8493-0485-7.
^ Resistance Welding Manufacturing Alliance. Resistance Welding Manual 4th. Resistance Welding Manufacturing Alliance. 2003: 18–12. ISBN 0-9624382-0-0.
^ Galvanic Corrosion. Corrosion Doctors. [2011-04-29].
^ Chambers, William; Chambers, Robert. Chambers's Information for the People L 5th. W. & R. Chambers. 1884: 312. ISBN 0-665-46912-8.
^ Copper.org: Education: Statue of Liberty: Reclothing the First Lady of Metals – Repair Concerns. Copper.org. [2011-04-11].
^ Rickett, B. I.; Payer, J. H. Composition of Copper Tarnish Products Formed in Moist Air with Trace Levels of Pollutant Gas: Hydrogen Sulfide and Sulfur Dioxide/Hydrogen Sulfide. Journal of the Electrochemical Society. 1995, 142 (11): 3723–3728. doi:10.1149/1.2048404.
^ Blitz, M. A.; Mitchell, S. A., Hackett, P. A. Gas-phase reactions of copper atoms: formation of copper dicarbonyl, bis(acetylene)copper, and bis(ethylene)copper. The Journal of Physical Chemistry. 1991-10-01, 95 (22): 8719–8726. doi:10.1021/j100175a055. 引文使用过时参数coauthors (帮助)
^ 《无机化学丛书》.第六卷 卤素 铜分族 锌分族. 科学出版社. 1.5 铜的化学性质.P468-469
^ 周为群 朱琴玉. 普通化学(第二版). 苏州大学出版社,2014.9. 第六章 重要元素及化合物. pp.205. ISBN 978-7-5672-1076-9
^ 《元素单质化学反应手册》P776-779
^ 17.017.1 Audi, G; Bersillon, O.; Blachot, J.; Wapstra, A.H. Nubase2003 Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
^ Interactive Chart of Nuclides. National Nuclear Data Center. [2011-04-08].
^ Okazawad, Hidehiko; Yonekura, Yoshiharu; Fujibayashi, Yasuhisa; Nishizawa, Sadahiko; Magata, Yasuhiro; Ishizu, Koichi; Tanaka, Fumiko; Tsuchida, Tatsuro; Tamaki, Nagara; Konishi, Junji. Clinical Application and Quantitative Evaluation of Generator-Produced Copper-62-PTSM as a Brain Perfusion Tracer for PET (PDF). Journal of Nuclear Medicine. 1994, 35 (12): 1910–1915. PMID 7989968.
^ Romano, Donatella; Matteucci, Fransesca. Contrasting copper evolution in ω Centauri and the Milky Way. Monthly Notices of the Royal Astronomical Society: Letters. 2007, 378 (1): L59–L63. Bibcode:2007MNRAS.378L..59R. arXiv:astro-ph/0703760. doi:10.1111/j.1745-3933.2007.00320.x.
^ 21.021.121.2 Emsley, John. Nature's building blocks: an A-Z guide to the elements. Oxford University Press. 2003-08-11: 121–125 [2011-05-02]. ISBN 978-0-19-850340-8.
^ Rickwood, P. C. The largest crystals (PDF). American Mineralogist. 1981, 66: 885.
^ Randazzo, Ryan. A new method to harvest copper. Azcentral.com. 2011-06-19 [2014-04-25].
^ Gordon, R. B.; Bertram, M.; Graedel, T. E. Metal stocks and sustainability. PNAS. 2006, 103 (5): 1209–1214. Bibcode:2006PNAS..103.1209G. PMC 1360560. PMID 16432205. doi:10.1073/pnas.0509498103.
^ 25.025.1 Leonard, Andrew. Peak copper?. Salon – How the World Works. 2006-03-02 [2008-03-23]. (原始内容存档于2008-03-07).
^ Brown, Lester. Plan B 2.0: Rescuing a Planet Under Stress and a Civilization in Trouble. New York: W.W. Norton. 2006: 109. ISBN 0-393-32831-7.
^ Schmitz, Christopher. The Rise of Big Business in the World, Copper Industry 1870–1930. Economic History Review. 2. 1986, 39 (3): 392–410. JSTOR 2596347. doi:10.1111/j.1468-0289.1986.tb00411.x.
^ Copper Trends: Live Metal Spot Prices. (原始内容存档于2012-05-01).
^ Ackerman, R. A Bottom In Sight For Copper. Forbes. 2009-04-02.
^ 30.030.1 Greenwood, Norman N.; Earnshaw, Alan., Chemistry of the Elements 2nd, Oxford: Butterworth-Heinemann, 1997, ISBN 0080379419
^ Watling, H. R. The bioleaching of sulphide minerals with emphasis on copper sulphides — A review (PDF). Hydrometallurgy. 2006, 84 (1, 2): 81–108. doi:10.1016/j.hydromet.2006.05.001. (原始内容 (PDF)存档于2011-08-18).
^ Samans, Carl. Engineering metals and their alloys. New York: Macmillan. 1949. OCLC 716492542.
^ International Copper Association.
^ Metal Stocks in Society: Scientific synthesis. 联合国环境署国际资源小组. 2010. (原始内容存档于2012-09-14).
^ Overview of Recycled Copper. Copper.org. 2010-08-25 [2011-11-08].
^ Gold Jewellery Alloys. World Gold Council. [2009-06-06]. (原始内容存档于2008-06-19).
^ Jacobson, David M.; Sangha, Satti P. S. A low melting point solder for 22 carat yellow gold (PDF). Gold Bulletin. 1996年3月, 29 (1): 3–9. [失效連結]
^ Balver Zinn Solder Sn97Cu3 (PDF). [2011-11-08]. (原始内容 (PDF)存档于2011-07-07).
^ 39.039.1 引用错误:没有为名为Holleman的参考文献提供内容
^ Holleman, A. F.; Wiberg, N. Inorganic Chemistry. San Diego: Academic Press. 2001. ISBN 978-0-12-352651-9.
^ Ralph L. Shriner, Christine K. F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson "The Systematic Identification of Organic Compounds" 8th edition, J. Wiley, Hoboken. ISBN 978-0-471-21503-5
^ Kay Saalwächter, Walther Burchard, Peter Klüfers, G. Kettenbach, and Peter Mayer, Dieter Klemm, Saran Dugarmaa "Cellulose Solutions in Water Containing Metal Complexes" Macromolecules 2000, 33, 4094–4107. doi:10.1021/ma991893m
^ "Modern Organocopper Chemistry" Norbert Krause, Ed., Wiley-VCH, Weinheim, 2002. ISBN 978-3-527-29773-3.
^ Berná, José; Goldup, Stephen; Lee, Ai-Lan; Leigh, David; Symes, Mark; Teobaldi, Gilberto; Zerbetto, Fransesco. Cadiot–Chodkiewicz Active Template Synthesis of Rotaxanes and Switchable Molecular Shuttles with Weak Intercomponent Interactions. Angewandte Chemie. 2008-05-26, 120 (23): 4464–4468. doi:10.1002/ange.200800891.
^ Rafael Chinchilla & Carmen Nájera. The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry. Chemical Reviews. 2007, 107 (3): 874–922. PMID 17305399. doi:10.1021/cr050992x.
^ An Addition of an Ethylcopper Complex to 1-Octyne: (E)-5-Ethyl-1,4-Undecadiene (PDF). Organic Syntheses. 1986, 64: 1. doi:10.15227/orgsyn.064.0001. (原始内容 (PDF)存档于2012-06-19).
^ Kharasch, M. S.; Tawney, P. O. Factors Determining the Course and Mechanisms of Grignard Reactions. II. The Effect of Metallic Compounds on the Reaction between Isophorone and Methylmagnesium Bromide. Journal of the American Chemical Society. 1941, 63 (9): 2308–2316. doi:10.1021/ja01854a005.
^ Imai, Sadako; Fujisawa, Kiyoshi; Kobayashi, Takako; Shirasawa, Nobuhiko; Fujii, Hiroshi; Yoshimura, Tetsuhiko; Kitajima, Nobumasa; Moro-oka, Yoshihiko. 63Cu NMR Study of Copper(I) Carbonyl Complexes with Various Hydrotris(pyrazolyl)borates: Correlation between 63Cu Chemical Shifts and CO Stretching Vibrations. Inorg. Chem. 1998, 37 (12): 3066–3070. doi:10.1021/ic970138r.
^ G. Brauer (编). Potassium Cuprate (III). Handbook of Preparative Inorganic Chemistry 1 2nd Ed. NY: Academic Press. 1963: 1015. 引文格式1维护:冗余文本 (link)
^ Schwesinger, Reinhard; Link, Reinhard; Wenzl, Peter; Kossek, Sebastian. Anhydrous phosphazenium fluorides as sources for extremely reactive fluoride ions in solution. Chemistry – A European Journal. 2006, 12 (2): 438. doi:10.1002/chem.200500838.
^ Lewis, E. A.; Tolman, W. B. Reactivity of Dioxygen-Copper Systems. Chemical Reviews. 2004, 104 (2): 1047–1076. PMID 14871149. doi:10.1021/cr020633r.
^ McDonald, M. R.; Fredericks, F. C.; Margerum, D. W. Characterization of Copper(III)-Tetrapeptide Complexes with Histidine as the Third Residue. Inorganic Chemistry. 1997, 36 (14): 3119–3124. PMID 11669966. doi:10.1021/ic9608713.
^ 53.053.1 CSA – Discovery Guides, A Brief History of Copper. Csa.com. [2008-09-12].
^ Rayner W. Hesse. Jewelrymaking through History: an Encyclopedia. Greenwood Publishing Group. 2007: 56. ISBN 0-313-33507-9. 书中未提及一手来源。
^ Copper. Elements.vanderkrogt.net. [2008-09-12].
^ Renfrew, Colin. Before civilization: the radiocarbon revolution and prehistoric Europe. Penguin. 1990 [2011-12-21]. ISBN 978-0-14-013642-5.
^ Cowen, R. Essays on Geology, History, and People. [2009-07-07].|chapter=被忽略 (帮助)
^ Timberlake, S. & Prag A.J.N.W. The Archaeology of Alderley Edge: Survey, excavation and experiment in an ancient mining landscape. Oxford: John and Erica Hedges Ltd. 2005: 396.
^ 59.059.1 CSA – Discovery Guides, A Brief History of Copper. CSA Discovery Guides. [2011-04-29].
^ Pleger, Thomas C. "A Brief Introduction to the Old Copper Complex of the Western Great Lakes: 4000–1000 BC", Proceedings of the Twenty-seventh Annual Meeting of the Forest History Association of Wisconsin, Oconto, Wisconsin, 5 October 2002, pp. 10–18.
^ Emerson, Thomas E. and McElrath, Dale L. Archaic Societies: Diversity and Complexity Across the Midcontinent, SUNY Press, 2009 ISBN 978-1-4384-2701-0.
^ Radivojević, Miljana; Rehren, Thilo. Tainted ores and the rise of tin bronzes in Eurasia, c. 6500 years ago. Antiquity Publications Ltd. December 2013.
^ McNeil, Ian. Encyclopaedia of the History of Technology. London ; New York: Routledge. 2002: 13, 48–66. ISBN 0-203-19211-7.
元素週期表 | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
1 | H | | He | ||||||||||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
↓ |
| ||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
|
