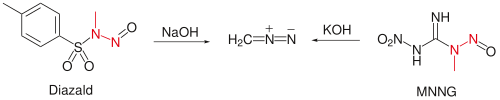重氮甲烷

 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP
| 重氮甲烷 | |
|---|---|
 | |
 | |
IUPAC名 Diazomethane | |
| 识别 | |
CAS号 | 334-88-3 |
PubChem | 9550 |
ChemSpider | 9176 |
SMILES |
|
InChI |
|
InChIKey | YXHKONLOYHBTNS-UHFFFAOYAZ |
ChEBI | 73716 |
KEGG | C19387 |
| 性质 | |
化学式 | CH2N2 |
摩尔质量 | 42.04 g·mol⁻¹ |
密度 | 1.4倍于空气 |
熔点 | -145 °C |
沸点 | -23 °C |
| 结构 | |
分子构型 | 直线形C=N=N骨架 |
偶极矩 | 极性 |
| 危险性 | |
警示术语 | R:R12, R19, R22, R66, R67 |
安全术语 | S:S9, S16, S29, S33 |
| 主要危害 | 有毒、爆炸性 |
| 相关物质 | |
| 相关官能团 | 叠氮化物 R-N=N=N 偶氮化合物 R-N=N-R |
| 相关化学品 | R2CN2 R = Ph、TMS、CF3 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
重氮甲烷是最简单的重氮化合物,化学式为CH2N2,室温下是一个不稳定的黄色有毒气体,具爆炸性,一般均使用它的乙醚溶液。它用作甲基化试剂,也用于制取亚甲基卡宾。
重氮甲烷是一个线形分子,有多个共振式,中间的氮原子带有部分正电荷,两端的碳和氮原子带有部分负电荷。其分子中可能还含有三原子四电子的大π键,从而导致重氮甲烷的偶极矩实际上并不大,与共振结构预测的结果有偏离。
目录
1 制备
2 反应
3 检验
4 相关化合物
5 安全
6 参考资料
7 外部链接
制备
实验室中制取的重氮甲烷的量通常以mmol计,方法是用N-甲基-N-亚硝基对甲苯磺酰胺(Diazald)的二乙二醇二甲醚和乙醚溶液与温热的氢氧化钠水溶液反应,蒸馏提纯;[1] 或以1-甲基-3-硝基-1-亚硝基胍(MNNG)为原料,低温加入氢氧化钾水溶液也可得到重氮甲烷。
反应
一般使用的是重氮甲烷的乙醚溶液。它可以进行的反应有:
- 将酰氯转化为多一个碳的羧酸、酯或酰胺(Arndt-Eistert合成)。反应首先生成重氮酮,氧化银催化下氮气离去,生成酰基卡宾,重排得到烯酮,再与水、醇或胺(氨)反应生成羧酸或羧酸衍生物。
- 与醛、酮反应生成多一个碳原子的酮(Buchner-Curtius-Schlotterbeck反应(1885))。首先发生亲核加成,之后也涉及基团的迁移。该反应可用于环酮的扩环,副产物是环氧化合物。
- 光解或热解生成亚甲基卡宾并放出氮气,常用作卡宾的来源。
甲基化试剂:与羧酸反应生成甲基酯,与酚、β-二酮及β-酮酯的烯醇型生成甲基醚。
- 与碱性的2H2O发生氢离子交换,生成氘代的C2H2N2。[2]
检验
重氮甲烷的含量可通过两种方法获得:一是与一定量且过量的苯甲酸在冷乙醚中反应,剩余的苯甲酸用基准氢氧化钠滴定;二是用分光光度法分析重氮甲烷的乙醚溶液,其在410nm处的消光系数为7.2。
相关化合物
很多重氮甲烷的衍生物也已制得:
- 两个三氟甲基取代的(CF3)2CN2(沸点为12–13 °C)。[3]
- 两个苯基取代的Ph2CN2(熔点29–30 °C)。[4]
三甲硅基取代的(CH3)3SiCHN2,已有出售,甲基化效果与重氮甲烷相当。[5]- 一个苯基取代的PhC(H)N2,红色液体,0.1mmHg时的沸点小于25 °C。[6]
安全
吸入重氮甲烷,及皮肤或眼部接触重氮甲烷都是有毒的(TLV 0.2ppm),症状包括心脏不适、头痛、身体虚弱、体力不支,严重时会致人昏倒。[7] 重氮甲烷与磨砂玻璃的接口接触,或加热至100 °C都可能会发生爆炸,使用时必须小心,避免以上材料的使用。
参考资料
^ J. A. Moore, D. E. Reed. "Diazomethane[永久失效連結]". Organic Syntheses Col. Vol. 5, page 351.
^ P. G. Gassman, W. J. Greenlee. "Dideuterodiazomethane[永久失效連結]". Organic Syntheses Col. Vol. 6, page 432.
^ W. J. Middleton, D. M. Gale. "Bis(Trifluoromethyl))diazomethane[永久失效連結]". Organic Syntheses Col. Vol. 6, page 161.
^ L. I. Smith, K. L. Howard. "Diphenyldiazomethane[永久失效連結]". Organic Syntheses Col. Vol. 3, page 351.
^ T. Shioiri, T. Aoyama, S. Mori. "Trimethylsilyldiazomethane[永久失效連結]". Organic Syntheses Col. Vol. 8, page 612.
^ X. Creary. "Tosylhydrazone Salt Pyrolyses: Phenydiazomethanes". Organic Syntheses Col. Vol. 7, p.438 (1990).; Vol. 64, p.207 (1986).
^ Muir, GD (ed.) 1971, Hazards in the Chemical Laboratory, The Royal Institute of Chemistry, London.
外部链接
- MSDS—重氮甲烷